超声波定位活体3D打印能否优化疾病治疗流程?
美国科研团队近期开展的一项研究,成功开发出基于超声波的体内直接3D打印技术。具体而言,该技术可将携带治疗组分的3D结构注入体内,并通过超声波在目标区域实现精准聚合。其核心目标在于将药物或功能细胞直接递送至疾病发生部位。目前,该技术已在啮齿类与兔类动物模型中完成初步验证,显示出修复体内损伤组织的潜力。这项被命名为"深部组织声学原位打印"(DISP)的创新方案,标志着生物制造领域的关键突破。
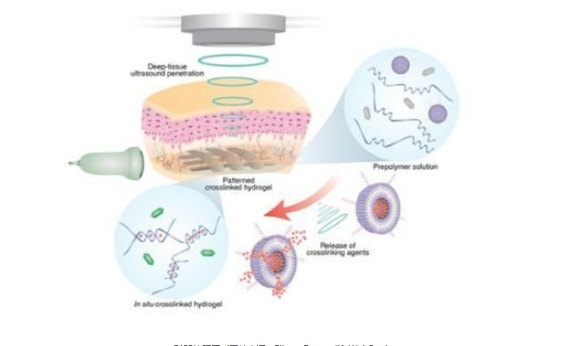 众所周知,3D生物打印在医疗领域具有革命性价值。其可定制个性化植入物,例如骨科修复支架或皮肤再生基质。然而,传统植入方法依赖侵入性操作,导致手术复杂度与患者风险增加。基于此,加州理工学院研究团队构建了基于影像引导的超声波打印平台,利用声波穿透深层组织的能力实现非侵入式操作。相较于红外线等短程能量形式,超声波可有效作用于肌肉、内脏等深部器官。
众所周知,3D生物打印在医疗领域具有革命性价值。其可定制个性化植入物,例如骨科修复支架或皮肤再生基质。然而,传统植入方法依赖侵入性操作,导致手术复杂度与患者风险增加。基于此,加州理工学院研究团队构建了基于影像引导的超声波打印平台,利用声波穿透深层组织的能力实现非侵入式操作。相较于红外线等短程能量形式,超声波可有效作用于肌肉、内脏等深部器官。
超声波引导3D打印:技术原理与动物验证
该技术核心在于聚焦超声波束与定制化生物墨水的协同作用。研究团队开发了由聚合物网络与交联组分构成的水凝胶体系,并引入针对特定疾病的治疗成分。其中,交联剂被封装于温度敏感型脂质载体中——当环境温度升至约40℃时,脂质外壳熔融释放内容物。这种设计可防止生物墨水在注入后过早固化,从而实现空间精准控制与快速成型。实验中,团队成功打印出星形与水滴形微结构。
 研究人员强调,DISP技术不仅能打印导电性生物材料,更可集成药物、活细胞或生物粘合剂,为多疾病治疗提供可能。实验证实,该技术可将功能化生物墨水精准沉积于兔后肢肌肉组织及小鼠膀胱肿瘤周边。加州理工学院生物医学工程师高伟指出:"红外光等传统能量形式仅能作用于浅表组织,而我们的技术可穿透至深部器官,并保持打印材料的生物相容性,这为复杂疾病治疗开辟了新路径。"
研究人员强调,DISP技术不仅能打印导电性生物材料,更可集成药物、活细胞或生物粘合剂,为多疾病治疗提供可能。实验证实,该技术可将功能化生物墨水精准沉积于兔后肢肌肉组织及小鼠膀胱肿瘤周边。加州理工学院生物医学工程师高伟指出:"红外光等传统能量形式仅能作用于浅表组织,而我们的技术可穿透至深部器官,并保持打印材料的生物相容性,这为复杂疾病治疗开辟了新路径。"
在兔类模型中,超声波打印深度已达皮下4厘米。针对膀胱癌小鼠的治疗实验显示,搭载化疗药物阿霉素的生物墨水通过DISP技术递送后,肿瘤细胞清除效率显著优于传统注射给药,且作用速度更快。
高伟团队透露:"下一步将在大型动物模型中验证技术可靠性,若进展顺利,计划于近年启动人体试验。长远目标是通过人工智能算法,实现在跳动心脏等动态器官内的自主精准打印,推动个性化医疗的终极愿景。"

